黄色ブドウ球菌の感染症を考える上では「感染臓器/entryがどこなのか」と「MSSAなのかMRSAなのか」が重要です。
微生物学的側面から診断を考えるのは感染症診療として全くおかしな話ですが、血液培養から黄色ブドウ球菌が検出された時にIEしか頭に浮かばないなんてことがないようにしてほしいです。
【病原体】
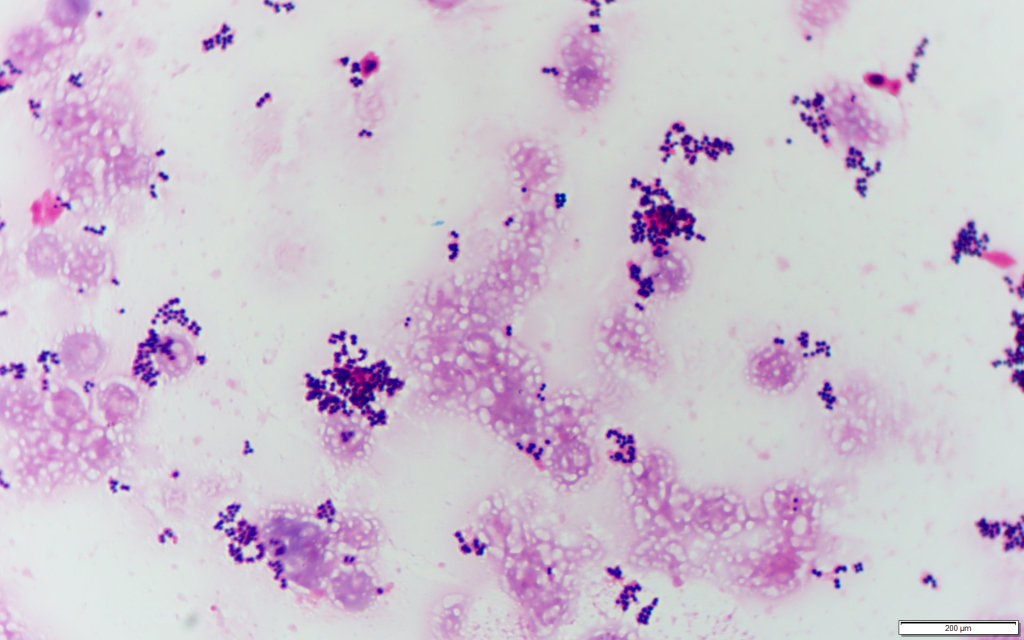
(引用元:グラム染色)
Staphylococcus aureusはブドウの房状の形態を示すグラム陽性球菌です(Gram Positive Cluster:GPC)です。Gram染色ではコアグラーぜ非産生菌の表皮ブドウ球菌(CNS)と異なり、菌体の周囲に濃いピンク色のフィブリン塊を認めることがあります。(感度78%,特異度95% Hadano Y, et al:BMC Infect Dis. 2018;18(1):490.)
メチシリン耐性かどうかは、感受性試験でオキサシリンMPIPCの感受性を見て判断します。そこでMPIPCのMICが≧4μg/mLであればMRSAと判断します。MRSAの感受性の表を見て仮にABPC /SBTの感受性がSだったとしても使用してはいけません。あくまでディスク上での試験であり、オキサシリン耐性となっていれば高確率で耐性を獲得されてしまう恐れがあり、治療失敗のリスクがあるので注意します。
【リスク】
過去12ヶ月以内のMRSA検出歴
【臨床像】
#皮膚・軟部組織感染症(蜂窩織炎を中心に)
皮膚表面に定着していた菌が傷口などから侵入して局所の感染症を起こします。蜂窩織炎の起因菌は溶連菌と黄色ブドウ球菌(S&S)がほとんどを占めます。溶連菌は皮膚の傷がなくても侵入して発症することがありますが、黄色ブドウ球菌では創部・皮膚バリア障害(アトピー性皮膚炎による掻爬痕、頻回の輸血や注射痕、糖尿病性足潰瘍等)をエントリーとします。後述する菌血症、右心系のIEを見た際には皮膚病変からのエントリーを考えます。しかしながら、発熱などの全身症状が出ても血液培養が陽性となることは10%以下とも言われており、必須ではありません。また皮下膿瘍形成(触ってみて波動を触れるかどうか)があれば穿刺して培養検査を行います。スワブ培養は常在菌を見るだけなので推奨されません。菌血症を疑う悪寒旋律を伴う症例やMRSAリスクがある症例では感受性特定のためにも血液培養を行った方がいいかもしれません。また、「蜂窩織炎では通常septic shockにならない」というのも覚えておきましょう。ショックバイタルでは壊死性筋膜炎を疑います。
#腸腰筋膿瘍/椎体椎間板炎/化膿性脊椎炎
これらの疾患は合併することも多く、並列した疾患の概念として捉えています。発熱、体動困難、腰痛などの主訴で疑いますが、高齢者では臓器特異的な主訴を訴えないことも多いです。逆に肺炎像や膿尿も認めない発熱患者さんでは意識して診察を行います。脊椎叩打痛や腸腰筋兆候(Psoas sign)を確かめます。起因菌は黄色ブドウ球菌・CNSが約半数を占めます。CTでは腸腰筋の左右差や椎体の終板が破壊されていないかを確認します。椎体椎間板炎や化膿性脊椎炎の確定診断にはMRIが必要です。
急激な経過をとる事は少ない印象の疾患ですが、急性の経過や進行を辿る例や神経症状を伴う例では硬膜外膿瘍を疑う必要があります。
脊髄硬膜外膿瘍についてはこちら

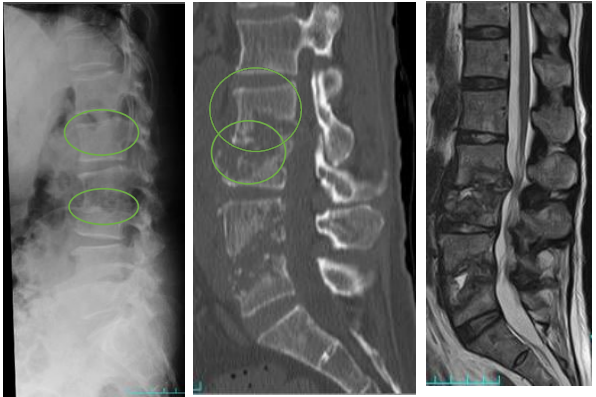
(引用:日本脊髄外科学会より。)終板(椎体の端の高吸収な領域)が壊されてるかどうか確認
#菌血症/カテーテル関連血流感染症/人工物感染症
人工物(長期留置透析カテーテル、中心静脈ポート、ペースメーカー、人工関節等)入っている人の発熱では黄色ブドウ球菌をはじめとしたGPCの関係した人工物感染を考える必要があります。
#感染性心内膜炎/敗血症性肺塞栓症
黄色ブドウ球菌が血液培養で検出された時には感染性心内膜炎(IE)を考える必要があります。黄色ブドウ球菌の播種性は凄まじく、さまざまなとこに播種性病変を認めます(とにかく凄まじいという印象を持ってください)。眼瞼結膜の点状出血、Osler結節,Janeway発疹、Roth斑(眼底の出血性梗塞) はもちろん、下の写真のように指趾末端ではなく膝にできたり、筋肉内などあらゆる場所に微小膿瘍を形成します。(以前紹介した壊疽性膿瘡よりも小さな病変が多いです。)
また左心系のIEではこのように全身の病変をきたしますが、右心系のIEでは肺野の胸膜直下付近にseptic emboliを形成し、空洞性病変を形成したりします。
これらのような病変を見たら(特に黄色ブドウ球菌による)感染性心内膜炎を疑います。
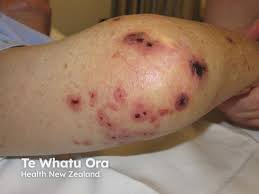
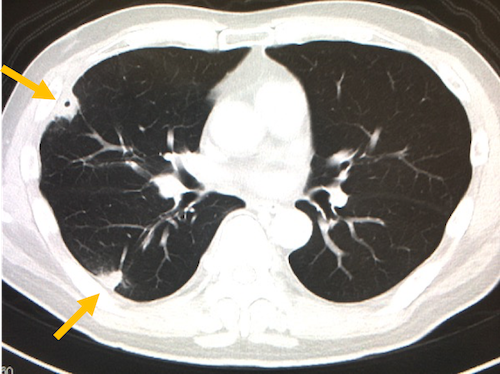
(引用:画像診断まとめ)
#尿路感染症(カテーテル関連尿路感染症)
はじめに言うと、単純性の尿路感染症で黄色ブドウ球菌が起因菌となる事は極めて稀です。無菌検体であるはずの尿から検出されることがあれば、①菌血症からの二次的な検出②カテーテル関連尿路感染症③colonizationによる定着を考えます。entryとして尿路感染症→菌血症というより流れより菌血症→細菌尿を疑い、他に真のentryがないか診察することが重要です。
(Open Forum Infect Dis. 2021 Mar 30;8(6):ofab158. PMID: 34189162)
【初期治療】
CEZ(+VCM)
血液培養でGPCの報告が来たら、それがclusterなのかchainかを確認します。先ほどのGram
染色の様子で黄色ブドウ球菌っぽいか表皮ブドウ球菌かを教えてくれることもあります。(感度は普通だが、得意度が高いことを考慮すると、この時点で黄色ブドウ球菌ぽいと言われたら恐らく、contaminationではなく真の菌血症です。CEZ+VCMに変更しましょう。全身状態にもよりますが、この時点で不要なGNRカバーは終了を検討しましょう。)まずは自分の臨床診断と一致しているかを確認しつつ、上記のような病変がないか、全身の診察を再度行うようにします。
感受性が判明したら、診断に応じた第一選択薬を選択します。感染性心内膜炎や人工物がある場合はガイドラインを見ながら適切な変更をしましょう。
MSSA→CEZ (*中枢神経移行性については、意見の分かれているところ)
MRSA→基本はVCM (どうしても使えない状況ではダプトマイシンやテイコプラニンを考慮。)(トラフ値15-20を目標、耐性菌を作らないために10以下にならないように気を付ける)
医学事始のサイトに黄色ブドウ球菌菌血症のSAB Bundleが紹介されているので確認してください。
最初からVCMを被せる必要があるかについてですが、全身状態によると思います。市中の蜂窩織炎の人にわざわざ全例で入院して血液培養をとってCEZ+VCMでの治療を開始しないですよね?一方で、先ほど見たようなseptic emboliを疑う所見があれば被せない人はいないと思います。
黄色ブドウ球菌は非常に厄介で、特にMRSAはVCMのトラフ値採血が必要だったり、そもそも使える抗生剤も少ないです。適切な臨床診断(感染臓器とエントリーの特定)と、そもそも保菌者にしないための手指消毒が重要です。
自らが痛い目を合わないように、手指衛生を日頃から心がけましょう。
・血液培養のGPC報告が来たら、clusterかchainか確認。clusterなら自分の臨床診断と合っているか確認する
・蜂窩織炎で通常septic shockにはならない。ショックなら壊死性筋膜炎を疑う。
・蜂窩織炎が両側の下肢で同時に起きることは稀。
・黄色ブドウ球菌を尿で認めたら、他にentryのある菌血症を疑う。特に皮膚のentryに注意しながら、IEがないかを調べる。
・黄色ブドウ球菌の中枢神経感染症にCEZは使えるか
→使えるかもしれないが、まだわからない。( Antimicrob Agents Chemother 0:e01857-24.)
・


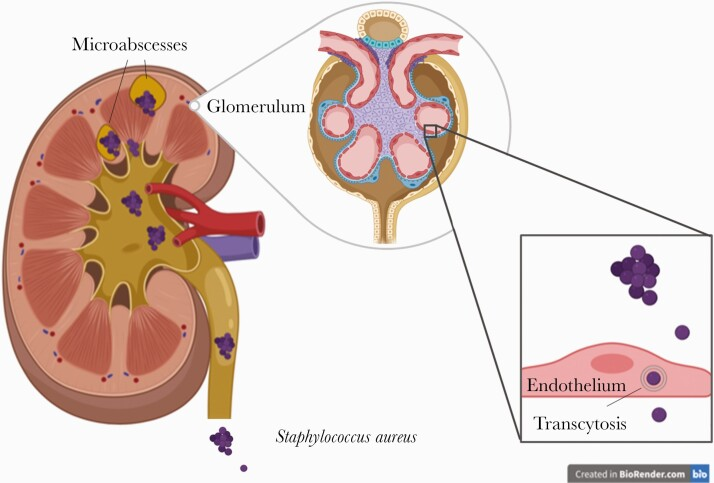
コメント
腎臓学会総会で、MRSAがどうやって髄質から皮質までの微小膿瘍形成をしていくか紹介されていました。腎髄質の高浸透圧が髄質が壊されるまで好中球の遊走を妨げるようです。
腎髄質の浸透圧を低下させるのがMRSAの腎障害にいいかもしれないという面白い発表がありました。